我院结构生物学团队揭示植物致病菌感知锌离子的分子机制
锌是生物体所必需的微量元素,它对很多重要蛋白的结构稳定性和催化活性至关重要(1)。然而,过量的锌会抑制呼吸链NADH氧化酶的活性,毒害细胞。为了生存,细胞必须准确感知并严格调节锌离子在细胞内的浓度(2)。细菌维持锌离子稳态主要依赖于锌调蛋白Zur,以及MerR家族和ArsR/SmtB家族的调节因子(ZntR,SmtB,CzrA)。虽然已经知道Zur属于铁吸收调控蛋白Fur家族成员,发现Zur不仅在维持病原细菌锌离子稳态起决定性作用,而且在调控病原细菌的致病力方面也起到极其重要的作用(3),但Zur感知锌离子的分子机制却一直未被解析。
2021年5月28日,我院结构生物学团队在国际著名学术期刊《Nucleic Acids Research》(IF5y=11.797)上发表题为“Structural basis for zinc-induced activation of a zinc uptake transcriptional regulator”的研究论文,解析了Zur感知锌离子的分子机制。

该研究通过解析十字花科黑腐病菌锌调蛋白(XcZur)在锌离子结合前后的晶体结构,揭示了锌感知诱导XcZur从闭合的非活性状态转化为开放的具有DNA结合能力的活性状态的构象变化过程。此外,文章通过突变体实验对XcZur的DNA识别机制进行了深入的分析,提出了XcZur与DNA结合的相互诱导契合模型。
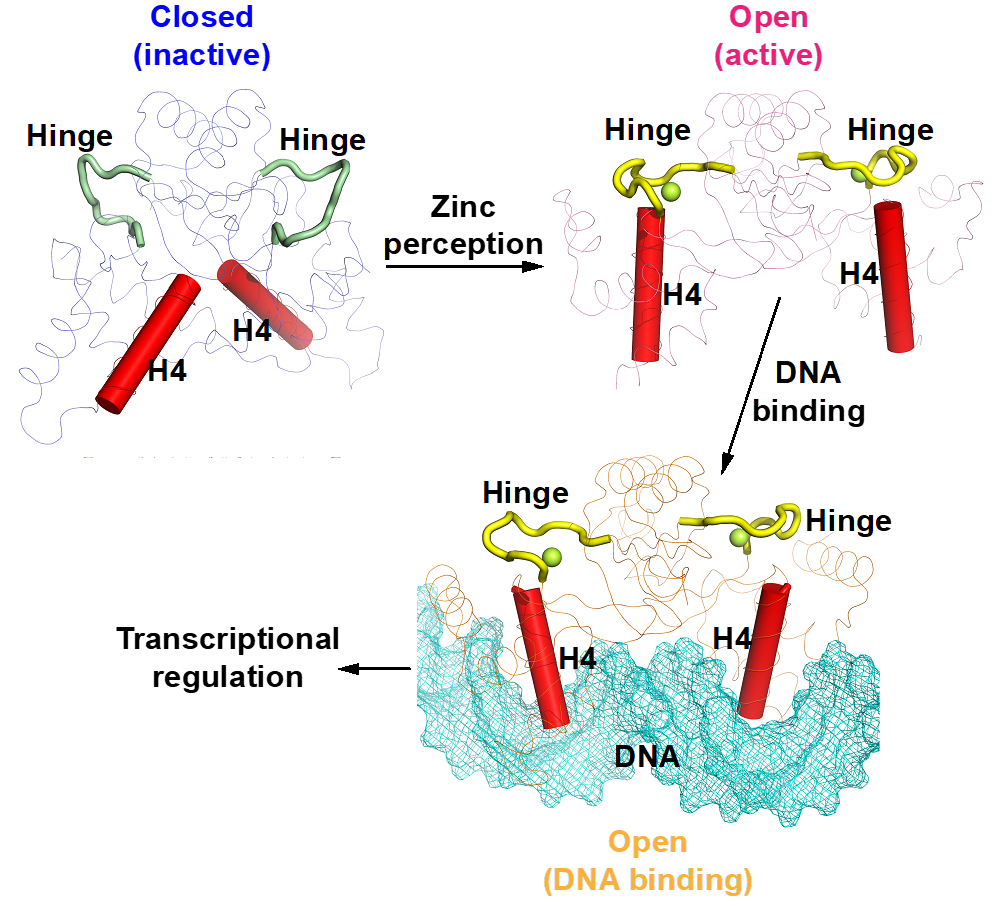
图1. 锌离子诱导锌调蛋白XcZur构象激活的结构模型
该研究首先利用分析超速离心(AUC)实验表明XcZur在溶液中以单体和二聚体的形式存在,而且在加锌的条件下能极大地促进单体形成稳定的二聚体。EMSA实验表明XcZur与DNA结合需要锌的感知,XcZur受锌离子激活之后能与编码锌吸收系统的三个基因的启动子DNA(P0267、P2472、P3788)特异性结合。AUC实验对复合物比例的测定显示,XcZur-P0267和XcZur-P2472都采用2:1的结合比,但XcZur-P3788采用3:1的结合比。
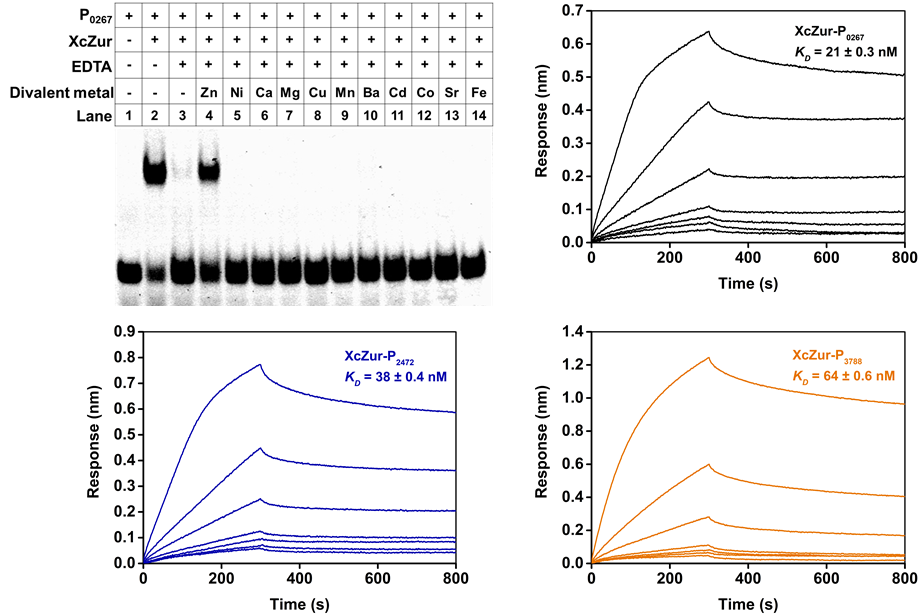
图2. 锌离子感知是XcZur结合DNA的必要条件
为了揭示锌离子激活XcZur蛋白的分子机理,该研究同时解析了XcZur在调节性锌离子结合前(apo XcZur)与结合后(holo XcZur)的蛋白结构。发现apo和holo XcZur都折叠成保守的二聚体结构,由几乎相同的二级结构元件组成,但存在显著的构象变化。Apo XcZur只结合一个结构性锌离子,而holo XcZur同时结合结构性锌离子和调节性锌离子。XcZur利用两个结合位点进行锌的感知和构象激活,结合在结构性位点的Zn在稳定二聚化结构域中起着不可或缺的作用,结合在调节位点的Zn在DNA结合结构域构象转变中起重要作用。通过结合调节性锌离子,XcZur经历了从“闭合”到“开放”的构象激活过程后,获得了DNA结合能力。
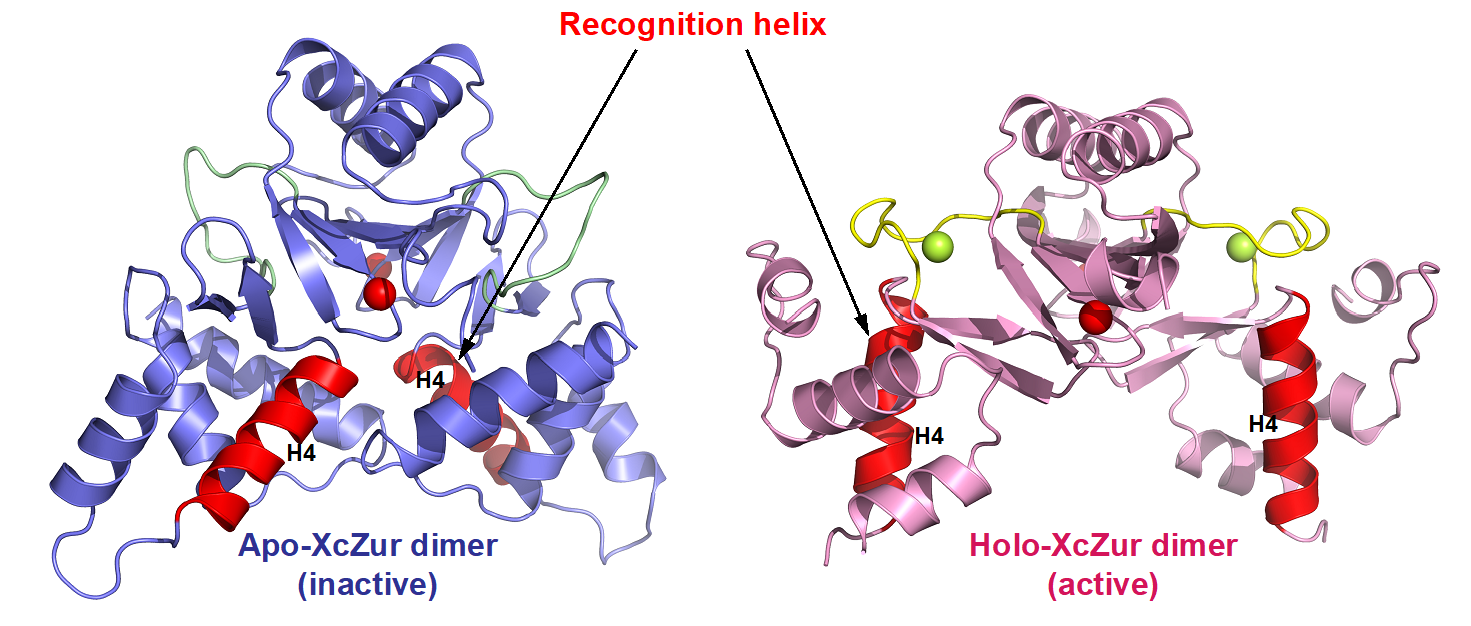
图3. 调节性锌离子的结合诱导XcZur从非激活构象转变为激活构象
该团队还通过氢氘交换质谱(HDX-MS)实验为锌感知介导的XcZur构象变化模型提供溶液状态的证据。实验表明,锌结合增加了DNA结合结构域的氘交换率,并暴露了后续DNA结合所需的所有关键结构元件。此外,XcZur与靶标DNA结合可以进一步稳定XcZur-DNA复合物,暗示这是一个诱导契合的过程。

图4. 锌离子结合及DNA结合诱导XcZur构象变化的溶液证据
尽管大多数已报道的Fur家族蛋白质只测定了非激活或活性状态结构中的一种,但此前的研究普遍认为Fur家族蛋白采用由“开放”到“闭合”的构象激活机制(4)。该研究首次揭示了一种完全相反的构象激活机制。通过分析激活状态和非激活状态Fur家族蛋白的晶体结构,该研究发现Fur蛋白只在非激活状态存在构象差异,而这种差异很可能是不同蛋白采用不同激活机制的原因。
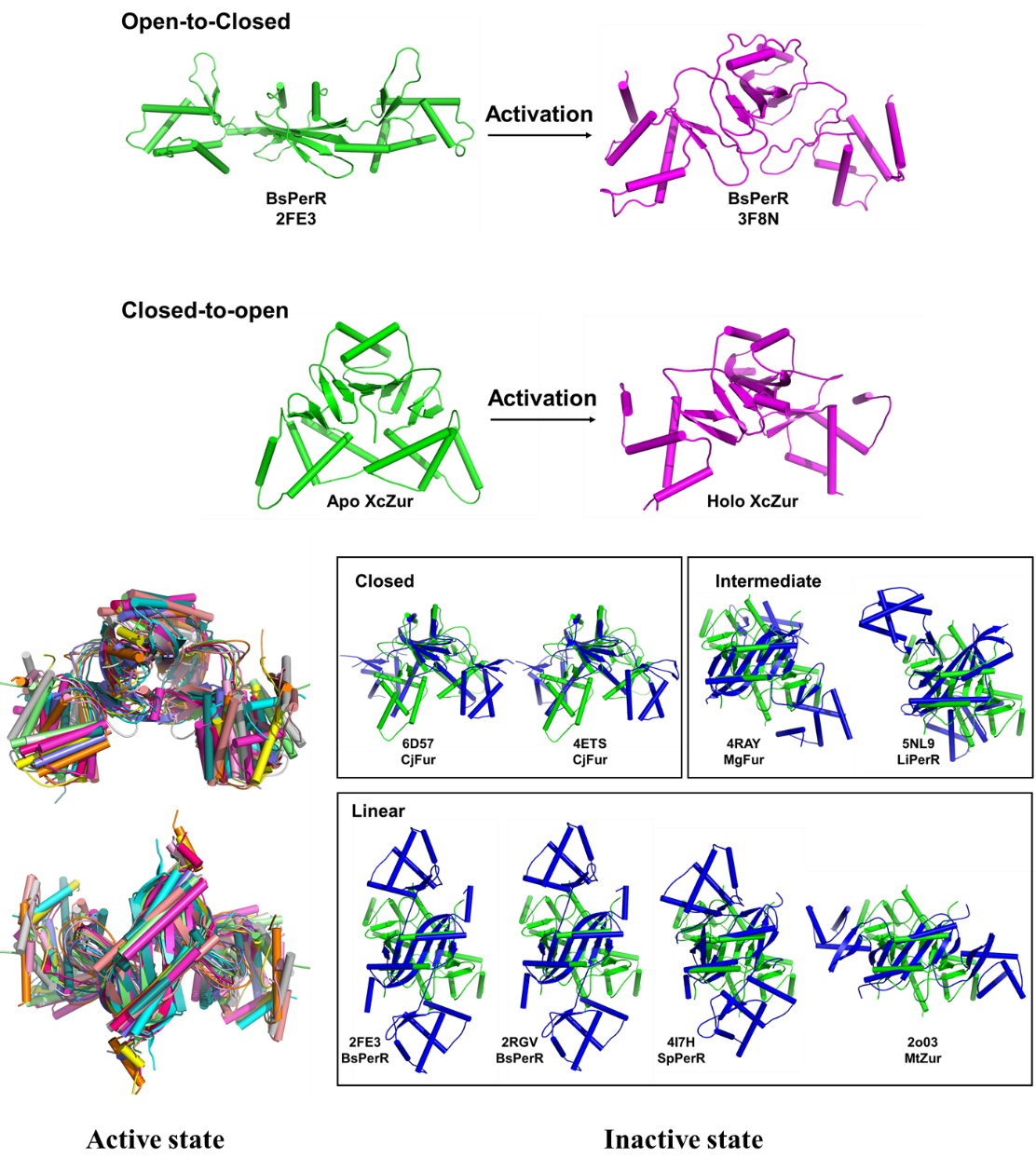
图5. Fur家族蛋白的非激活构象决定其激活方式
该合作团队前期研究发现XcZur既能负调控编码锌离子吸收系统的三个相关基因的表达,也能正调控编码锌离子排放泵的一个基因的表达(5)。当前研究发现XcZur可以特异性结合三个锌离子吸收基因XC0267/XC2472/XC3788中启动子的-35至-10区,却不能结合锌离子排放基因XC2976的-35至-10区。提示XcZur与XC2976的结合不但不会封闭-10区和-35区等RNA聚合酶结合位点,反而增加XC2976启动子的可及性,促进RNA聚合酶对XC2976启动子的结合并增强该基因的转录。XcZur以3:1的方式结合P3788的结构机理,及其正向调节十字花科黑腐病菌致病力的分子机理有待进一步研究。
综上,该研究提出了一种非常新颖的构象激活机制,并指出XcZur与DNA的结合是一个相互诱导契合的过程,诱导契合机制也解释了为什么XcZur能够以多样的模式结合不同的靶标DNA。该工作对揭示其它金属离子依赖的转录调控蛋白的作用分子机理具有重要的参考价值和指导意义。
我院硕士研究生刘芬梅和苏子惠为论文共同第一作者,明振华教授为论文通讯作者。该研究得到了国家自然科学基金、广西八桂学者计划、广西自然科学基金、亚热带农业生物资源保护与利用国家重点实验室青年人才专项和广西甘蔗生物学重点实验室青年人才专项等项目的联合资助。
原文链接:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkab432/6287845#
参考文献
(1) Berg, J.M. and Shi, Y. (1996) The galvanization of biology: a growing appreciation for the roles of zinc. Science, 271, 1081-1085.
(2) Kasahara, M. and Anraku, Y. (1974) Succinate- and NADH oxidase systems of Escherichia coli membrane vesicles. Mechanism of selective inhibition of the systems by zinc ions. J Biochem, 76, 967-976.
(3) El-Gebali, S., Mistry, J., Bateman, A., Eddy, S.R., Luciani, A., Potter, S.C., Qureshi, M., Richardson, L.J., Salazar, G.A., Smart, A. et al. (2019) The Pfam protein families database in 2019. Nucleic Acids Res, 47, D427-D432.
(4) Jacquamet, L., Traore, D.A., Ferrer, J.L., Proux, O., Testemale, D., Hazemann, J.L., Nazarenko, E., El Ghazouani, A., Caux-Thang, C., Duarte, V. et al. (2009) Structural characterization of the active form of PerR: insights into the metal-induced activation of PerR and Fur proteins for DNA binding. Mol Microbiol, 73, 20-31.
(5) Huang, D.L., Tang, D.J., Liao, Q., Li, H.C., Chen, Q., He, Y.Q., Feng, J.X., Jiang, B.L., Lu, G.T., Chen, B. et al. (2008) The Zur of Xanthomonas campestris functions as a repressor and an activator of putative zinc homeostasis genes via recognizing two distinct sequences within its target promoters. Nucleic Acids Res, 36, 4295-4309.