近日,我院何正国教授团队以“Insertion sequence transposition activates antimycobacteriophage immunity through anlsr2‐silenced lipid metabolism gene island”为题在mLife杂志发表了分枝杆菌抗病毒防御新机制。该研究团队基于耻垢分枝杆菌转座子插入突变文库筛选获得的广谱抗噬菌体突变株,开展了比较蛋白质组学、基因岛缺少/互补、噬菌体吸附、脂质组及噬菌体进化分析等实验,发现分枝杆菌的插入序列IS1096能高频率插入lsr2基因中激活被阻遏的LOS基因岛,从而抑制噬菌体的吸附并赋予突变分枝杆菌获得广谱抗噬菌体的能力。博士生李亚坤为论文第一作者,何正国教授为论文的通讯作者,betway必威西汉姆联官网是论文的唯一完成单位。
结核分枝杆菌(Mycobacterium tuberculosis, Mtb)是人类结核病的病原体,每年造成约160万人死亡。近年来,随着多重耐药菌株的出现,结核病防控面临严峻挑战,急需寻找辅助甚至代替抗生素治疗的方案。噬菌体(bacteriophage)作为专门“捕食”细菌的病毒,对病原体具有直接的杀伤或杀灭作用,在治疗病原菌感染方面具有良好的应用前景。最新研究发现,尽管分枝杆菌基因组编码一些潜在的免疫系统,但是这些免疫系统在噬菌体防御中的作用在很大程度上仍不清楚。Lsr2是存在于分枝杆菌和放线菌中保守的类核相关蛋白,以直接或者间接的方式控制许多基因的转录,参与许多细胞过程和抗生素耐药,但其抗噬菌体防御的具体分子机制尚不清楚。
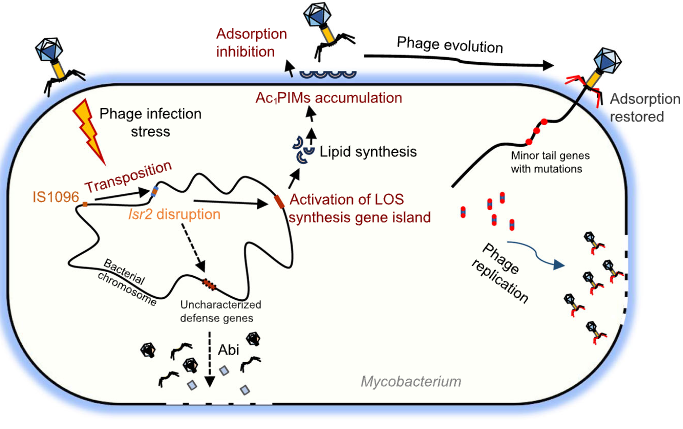
该研究发现噬菌体感染耻垢分枝杆菌后,IS1096转座子可以高频易位并插入lsr2基因,并激活由11个基因组成的LOS代谢基因岛(MSMEG_4727– 4737)的表达,从而赋予宿主对分枝杆菌噬菌体的广泛抗性。此外,该研究还成功进化分离出一种噬菌体,这种噬菌体的尾丝基因发生了突变,可以重新摆脱分枝杆菌的防御,产生成熟子代噬菌体。
该研究发现了一种以前未定义的信号通路,极大地丰富了我们对分枝杆菌抗噬菌体防御进化策略和分子机制的理解。同时,这项工作表明,分枝杆菌的内源插入序列能够激活细菌的抗噬菌体防御基因岛表达,从而帮助细菌在短时间内快速进化获得广谱抗噬菌体能力,这是一种完全不同于CRISPR的获得性抗噬菌体防御新机制。
mLife是由中国科学院主管、中国科学院微生物研究所主办(中国微生物学会为合作单位)的我国微生物学领域第一本综合性高起点英文期刊。mLife瞄准全球微生物学领域高水平科研成果和前沿进展,报道内容覆盖微生物学各个学科。mLife的办刊目标是打造微生物学领域综合性国际旗舰期刊。目前已被Scopus、DOAJ、CSCD、CAS、Google Scholar、ESCI等国内外数据库收录。